Pembahasan soal rumus alkana, alkena, alkuna
Tuesday, October 3, 2017
Edit
Rumus alkana, alkena, alkuna dan pembahasan
Nomor 1
Hidrokarbon yang banyak digunakan sebagai bahan dasar pembuatan plastik adalah golongan alkena. Rumus umum senyawa alkena adalah....
A. CnH2n
B. CnH2n+1
C. CnH2n+2
D. CnH2n-1
E. CnH2n - 2
Pembahasan
Rumus umum alkena = CnH2n
Rumus umum alkana = CnH2n+2
Rumus umum alkuna = CnH2n-2
Jawaban: A
Nomor 2
Untuk memudahkan memahami berbagai senyawa, senyawa tersebut dikelompokkan ke dalam deret homolog. Kelompok senyawa yang merupakan deret homolog adalah....
A. CH4, C2H4, C3H4
B. C2H6, C3H6, C4H6
C. CH4, C2H6, C3H8
D. C2H4, C4H8, C6H14
E. C6H6, C3H8, C4H18
Pembahasan
Deret homolog menunjukkan deretan senyawa yang satu golongan, bisa alkana semua, alkena semua atau alkuna semua. Untuk soal nomor 2, yang termasuk deret homolog adalah pilihan C, karena termasuk senyawa Alkana semua.
CH4 = n = 1 maka jika dimasukkan ke rumus CnH2n+2 = CH4
C2H6 = n = 2 maka jika dimasukkan ke rumus CnH2n+2 = C2H6
C3H8 = n = 3 maka jika dimasukkan ke rumus CnH2n+2 = C3H8
Jawaban: C
Nomor 3
Deret homolog senyawa golongan alkuna adalah...
A. C2H2, C2H4, C2H6
B. C2H2, C3H4, C4H8
C. C2H2, C3H4, C4H6
D. C2H4, C3H6, C4H8
E. C2H4, C3H12, C4H10
Pembahasan
Senyawa alkuna mempunyai rumus CnH2n-2. Deret senyawa yang sesuai dengan rumus tersebut adalah C2H2, C3H4, C4H6.
Jawaban: C
Nomor 4
Rumus kimia senyawa hidrokarbon yang merupakan rumus kimia alkana adalah...
A. C6H14
B. C7H12
C. C7H10
D. C7H14
E. C8H16
Pembahasan
Senyawa alkana mempunyai rumus: CnH2n+2
C6H14 = n = 6 maka CnH2n+2 = C6H14 (alkana)
C7H12 = n = 7 maka CnH2n+2 = C7H16 jadi C7H12 bukan alkana
C7H10 dan C7H14 juga bukan alkana.
C8H16 n = 8 maka CnH2n+2 = C8H18 jadi C8H16 bukan alkana.
Jawaban: A
Nomor 5
Senyawa homolog setelah C6H14 adalah...
A. C4H6
B. C7H12
C. C7H10
D. C7H16
E. C8H18
Pembahasan
C6H14 adalah senyawa alkana karena sesuai dengan rumus CnH2n+2. Jadi untuk menentukan senyawa homolog, cari senyawa alkana pada pilihan. Yang termasuk senyawa alkana adalah C7H16, karena = = 7 maka CnH2n+2 = C7H16.
Jawaban: D
Nomor 6
Terdapat lima macam rumus molekul senyawa hidrokarbon sebagai berikut:
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 3 dan 4
E. 4 dan 5
Pembahasan
Senyawa alkena mempunyai rumus CnH2n.
C2H4 = alkena
C3H6 = alkena
C5H12 = alkana
C4H10 = alkana
C6H14 = alkana
Jawaban: A


Nomor 1
Hidrokarbon yang banyak digunakan sebagai bahan dasar pembuatan plastik adalah golongan alkena. Rumus umum senyawa alkena adalah....
A. CnH2n
B. CnH2n+1
C. CnH2n+2
D. CnH2n-1
E. CnH2n - 2
Pembahasan
Rumus umum alkena = CnH2n
Rumus umum alkana = CnH2n+2
Rumus umum alkuna = CnH2n-2
Jawaban: A
Nomor 2
Untuk memudahkan memahami berbagai senyawa, senyawa tersebut dikelompokkan ke dalam deret homolog. Kelompok senyawa yang merupakan deret homolog adalah....
A. CH4, C2H4, C3H4
B. C2H6, C3H6, C4H6
C. CH4, C2H6, C3H8
D. C2H4, C4H8, C6H14
E. C6H6, C3H8, C4H18
Pembahasan
Deret homolog menunjukkan deretan senyawa yang satu golongan, bisa alkana semua, alkena semua atau alkuna semua. Untuk soal nomor 2, yang termasuk deret homolog adalah pilihan C, karena termasuk senyawa Alkana semua.
CH4 = n = 1 maka jika dimasukkan ke rumus CnH2n+2 = CH4
C2H6 = n = 2 maka jika dimasukkan ke rumus CnH2n+2 = C2H6
C3H8 = n = 3 maka jika dimasukkan ke rumus CnH2n+2 = C3H8
Jawaban: C
Nomor 3
Deret homolog senyawa golongan alkuna adalah...
A. C2H2, C2H4, C2H6
B. C2H2, C3H4, C4H8
C. C2H2, C3H4, C4H6
D. C2H4, C3H6, C4H8
E. C2H4, C3H12, C4H10
Pembahasan
Senyawa alkuna mempunyai rumus CnH2n-2. Deret senyawa yang sesuai dengan rumus tersebut adalah C2H2, C3H4, C4H6.
Jawaban: C
Nomor 4
Rumus kimia senyawa hidrokarbon yang merupakan rumus kimia alkana adalah...
A. C6H14
B. C7H12
C. C7H10
D. C7H14
E. C8H16
Pembahasan
Senyawa alkana mempunyai rumus: CnH2n+2
C6H14 = n = 6 maka CnH2n+2 = C6H14 (alkana)
C7H12 = n = 7 maka CnH2n+2 = C7H16 jadi C7H12 bukan alkana
C7H10 dan C7H14 juga bukan alkana.
C8H16 n = 8 maka CnH2n+2 = C8H18 jadi C8H16 bukan alkana.
Jawaban: A
Nomor 5
Senyawa homolog setelah C6H14 adalah...
A. C4H6
B. C7H12
C. C7H10
D. C7H16
E. C8H18
Pembahasan
C6H14 adalah senyawa alkana karena sesuai dengan rumus CnH2n+2. Jadi untuk menentukan senyawa homolog, cari senyawa alkana pada pilihan. Yang termasuk senyawa alkana adalah C7H16, karena = = 7 maka CnH2n+2 = C7H16.
Jawaban: D
Nomor 6
Terdapat lima macam rumus molekul senyawa hidrokarbon sebagai berikut:
- C2H4
- C3H6
- C5H12
- C4H10
- C6H14
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 3 dan 4
E. 4 dan 5
Pembahasan
Senyawa alkena mempunyai rumus CnH2n.
C2H4 = alkena
C3H6 = alkena
C5H12 = alkana
C4H10 = alkana
C6H14 = alkana
Jawaban: A
1. Alkana
Senyawa
alkana merupakan rantai karbon yang paling sederhana. Alkana
merupakan senyawa hidrokarbon jenuh karena memiliki ikatan tunggal.
Rumus umum alkana CnH2n+2. Senyawa paling
sederhana dari alkana yaitu metana. Metana hanya memiliki satu atom
karbon yang mengikat empat atom H. Tabel berikut menyajikan data
sepuluh alkana rantai lurus pertama.

Deret
Homolog Alkana
Berdasarkan
tabel di depan dapat dilihat bahwa perbedaan kesepuluh senyawa di
atas terletak pada jumlah gugus metilena (– CH2 –).
Senyawa dengan kondisi demikian disebut homolog. Susunan senyawa yang
dibuat sedemikian rupa sehingga perbedaan dengan tetangga dekatnya
hanya pada jumlah metilena disebut deret homolog.
a.
Tata nama alkana
Penamaan
alkana mengikuti sistem IUPAC, yaitu sistem tata nama yang didasarkan
pada gagasan bahwa struktur sebuah senyawa organik dapat digunakan
untuk menurunkan namanya dan sebaliknya, bahwa suatu struktur yang
unik dapat digambar untuk tiap nama.
Dasar
sistem IUPAC yaitu alkana rantai lurus.
1)
Alkana rantai lurus (tidak bercabang)
Alkana
rantai lurus diberi nama sesuai dengan jumlah atom karbonnya
sebagaimana tercantum dalam tabel di atas. Terkadang ditambahkan
normal (n) di depan nama alkana.
2)
Alkana siklis (rantai tertutup)
Alkana
rantai siklis (tertutup) diberi nama menurut banyaknya atom karbon
dalam cincin, dengan penambahan awalan siklo-.
3)
Alkana bercabang (memiliki rantai samping)
Senyawa
alkana terkadang berikatan dengan unsur lain pada salah satu atau
beberapa atom karbonnya. Unsur lain dalam rantai alkana tersebut
biasa dinamakan substituen. Jenis substituen alkana yang sering
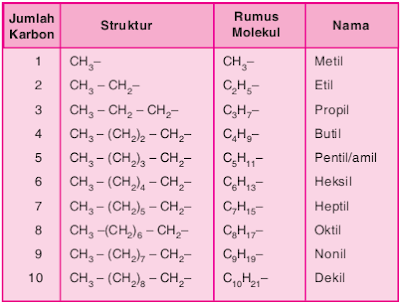
dijumpai yaitu gugus alkil. Gugus alkil adalah alkana yang kehilangan
1 atom H. Penamaannya sama dengan alkana, hanya akhirannya diubah
menjadi -il. Rumus umumnya CnH2n+1. Tabel
berikut menyajikan deret gugus alkil.
Gugus
Alkil
Jika
alkana memiliki rantai samping maka penamaannya mengikuti aturan
sebagai berikut.
- Rantai terpanjang merupakan rantai utama.
- Rantai utama diberi nomor mulai dari ujung rantai yang memiliki substituen.
- Urutan penulisan nama : nomor cabang, nama cabang, nama alkana rantai utama.
- Jika terdapat gugus metil pada atom C nomor 2, nama alkana diberi awalan iso.
- Jika alkana memiliki cabang yang sama lebih dari satu, nama cabang digabung menjadi satu dan diberi awalan di-(jumlah cabang ada dua), tri-(jumlah cabang ada 3), tetra-(jumlah cabang ada empat).
- Jika alkana memiliki cabang yang berbeda, penulisan nama diurutkan berdasarkan urutan abjad.
b.
Isomer alkana
Isomer
adalah suatu senyawa yang memiliki rumus molekul sama, namun rumus
strukturnya berbeda. Senyawa alkana paling rendah yang dapat memiliki
isomer yaitu butana (C4 H10).
c.
Sifat-sifat alkana
1)
Sifat fisis
- Alkana merupakan senyawa nonpolar.
- Bentuk alkana rantai lurus pada suhu kamar berbeda-beda.
- Semakin banyak jumlah atom karbon, semakin tinggi titik didihnya.
- Adanya rantai cabang pada senyawa alkana menurunkan titik didihnya.
- Larut dalam pelarut nonpolar (CCl4) atau sedikit polar (dietil eter atau benzena) dan tidak larut dalam air.
- Alkana lebih ringan dari air.
2)
Sifat kimia
- Alkana dan sikloalkana tidak reaktif, cukup stabil apabila dibandingkan dengan senyawa organik lainnya. Oleh karena kurang reaktif, alkana kadang disebut paraffin (berasal dari bahasa Latin: parum affins, yang artinya "afinitas kecil sekali").
- Alkana dapat bereaksi dengan halogen, salah satu atom H diganti oleh halogen. Reaksi dengan halogen tersebut dinamakan reaksi halogenasi dan menghasilkan alkil halida.Contoh: CH4 + Cl 2 → CH3 Cl + HCl
- Alkana dapat dibakar sempurna menghasilkan CO2 dan H2O.Contoh: CH4 + 2O2 → CO2 + 2H2O
2. Alkena
Alkena
merupakan senyawa hidrokarbon tidak jenuh dengan ikatan rangkap dua
(–C=C–). Alkena paling sederhana yaitu etena, C2H4.
Rumus umum alkena C2H2n. Tabel berikut
menyajikan deret homolog alkena.
Deret
Homolog Alkena
a.
Tata nama alkena
1)
Alkena rantai lurus
Atom
karbon yang berikatan rangkap ( C = C ) diberi nomor yang menunjukkan
ikatan rangkap tersebut. Penomoran dimulai dari ujung rantai yang
paling dekat dengan ikatan rangkap.
2)
Alkena dengan rantai bercabang
- Rantai utama yaitu rantai yang terpanjang dan mengandung ikatan rangkap.
- Penomoran rantai utama diawali dari yang paling dekat dengan ikatan rangkap, bukan cabang yang terdekat.
- Urutan penulisan nama: nomor cabang, nama cabang, nomor ikatan rangkap, nama alkena.
3)
Alkena dengan lebih dari satu ikatan rangkap
Jika
alkena memiliki lebih dari satu ikatan rangkap, namanya diberi
tambahan diena (untuk dua ikatan rangkap) atau triena (untuk tiga
ikatan rangkap).
b.
Isomer alkena
Alkena
paling rendah yang memiliki isomer yaitu butena (C4H8).
Alkena memiliki dua jenis isomer sebagai berikut.
1)
Isomer posisi
Isomer
posisi adalah senyawa-senyawa dengan rumus molekul sama, namun
memiliki penataan atom yang berbeda. Alkana hanya memiliki satu jenis
isomer posisi, namun alkena memiliki dua jenis perubahan penataan
atom, yaitu:
- isomer posisi di mana perubahan posisi dialami oleh ikatan rangkap,
- isomer posisi di mana perubahan posisi dialami oleh rantai cabang.
2)
Isomer geometri
Isomer
geometri menjadikan ikatan rangkap sebagai sumbu. Syarat isomer
geometri yaitu atom C yang berikatan rangkap harus mengikat dua gugus
atom yang berlainan.
c.
Sifat alkena
1)
Sifat fisika
Alkena
memiliki sifat fisika yang sama dengan alkana. Perbedaannya yaitu,
alkena sedikit larut dalam air. Hal ini disebabkan oleh adanya ikatan
rangkap yang membentuk ikatan S. Ikatan S tersebut akan ditarik oleh
hidrogen dari air yang bermuatan positif sebagian.
2)
Sifat Kimia
a)
Oksidasi
Sebagaimana
hidrokarbon pada umumnya, pembakaran/ oksidasi alkena juga akan
menghasilkan CO2 dan H2O.
b)
Adisi H2
Reaksi
adisi merupakan reaksi pemutusan ikatan rangkap. Pada adisi alkena,
ikatan rangkap berubah menjadi ikatan tunggal.
c)
Adisi halogen (F2 , Br2 , I2)
Reaksi
adisi oleh halogen akan memutus rantai rangkap alkena membentuk
alkana. Selanjutnya halogen tersebut akan menjadi cabang/substituen
dari alkana yang terbentuk
d)
Adisi asam halida
Adisi
dengan asam halida akan memutus ikatan rangkap pada alkena menjadi
alkana dengan mengikuti aturan Markovnikof. Atom H dari asam halida
akan terikat pada atom karbon dari alkena tidak simetris yang
memiliki atom H paling banyak. Jika atom C yang berikatan rangkap
memiliki jumlah H yang sama, halida akan terikat pada atom C yang
paling panjang. CH3 CH = CHCH3 →
ikatan rangkap membagi sama banyak atom C dan atom H →
simetris CH3CH 2CH = CH2 →
ikatan rangkap tidak membagi sama banyak atom C dan H →
tidak simetris
3. Alkuna
Alkuna
merupakan hidrokarbon tidak jenuh yang memiliki ikatan rangkap tiga
(– C ≡ C –). Alkuna
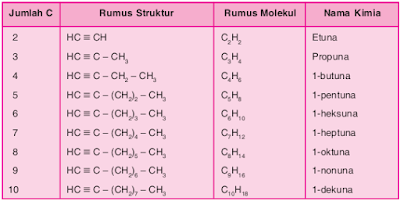
mempunyai rumus umum CnH2n-2. Alkuna paling
sederhana yaitu etuna, C2H2. Deret homolog
alkuna sebagai berikut.

Deret
Homolog Alkuna
a.
Tata nama alkuna
Aturan
pemberian nama alkuna sama dengan alkena, hanya diakhiri -una.
b.
Isomer alkuna
Sebagaimana
alkana, alkuna juga hanya memiliki isomer posisi. Alkuna tidak
memiliki isomer geometri. Alkuna paling rendah yang memiliki isomer
yaitu butuna, C4H6. Akibat pengaruh ikatan
rangkap, isomer posisi alkuna mengalami dua jenis pergeseran penataan
atom, yaitu:
- somer posisi di mana perubahan posisi dialami oleh ikatan rangkap,
- Isomer posisi di mana perubahan posisi dialami oleh rantai cabang.
c.
Sifat alkuna
1)
Sifat fisika
Sifat
fisika alkuna sama dengan alkana dan alkena. Alkuna juga sedikit
larut dalam air.
2)
Sifat kimia
a)
Oksidasi
Sebagaimana
hidrokarbon pada umumnya, alkun
b)
Adisi H2
Alkuna
mengalami dua kali adisi oleh H2 untuk menghasilkan
alkana.
c)
Adisi Halogen

d)
Adisi Asam halida
Adisi
alkuna oleh asam halida mengikuti aturan Markovnikov sebagaimana pada
alkena.